נטייה מורשת לפתח סרטן שד ושחלות– מה המשמעות? ומה עושים עם זה :BRCA
מקורות: ויקירפואה/ פרופ' איתן פרידמן/ קריאה כללית/ הרופא המטפל
במרבית מקרי סרטן השד והשחלות לחולה אין חולי סרטן נוספים במשפחה. מקרים אלה מכונים לכן מקרים אקראיים (ספוראדיים – sporadic cases)
 |
| קרדיט:www.womenhealthzone.com |
במיעוט המקרים - נראה צבר לא שיגרתי של מקרי סרטן במשפחה – סרטן שד משפחתי – familial breast cancer ובחלק מהמקרים הללו ניתן לזהות תבנית הורשה ברורה. מקרים אלה מכונים "סרטן שד מורש" - Inherited breast cancer
אפידמיולוגיה
בעולם, מידי שנה, מאובחנות כ-1,400,000 נשים חדשות (!) כחולות בסרטן השד, וכ-225,000 בסרטן שחלות. בישראל מספרים אלה מגיעים לכ-4,000 ו-320 נשים בשנה, בהתאמה.
לכן, סרטן השד היא מחלה שכיחה והסיכון לפתח סרטן שד לאורך החיים (Lifetime risk) לכל אישה באוכלוסייה הכללית בישראל הוא כ-12% ולסרטן של השחלות הסיכון לאורך החיים מוערך בכ 1.5%.
קיימים גורמי סיכון רבים לפתח סרטן שד שקיומם מעלה את הסיכון מעבר לרמת הסיכון באוכלוסייה הכללית:
- חשיפה לגורמי סביבה – כגון חשיפה לקרינה ונטילת הורמונים
- גורמים מילדותיים – כגון גיל בעת הלידה הראשונה והנקה
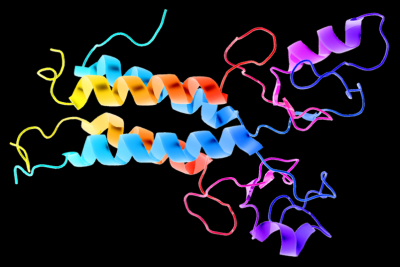 |
| הדמיית תלת מימד של החלבון BRCA1, החשוב לתיקון DNA פגום ומוטציה ב BRCA1 תוצאתה היא עלייה בסרטן שד ושחלות. קרדיט תמונה: וויקימדיה |
- משקל גוף עודף, היעדר עיסוק בספורט ועוד
אחד מגורמי הסיכון העיקריים לסרטן שד ושחלות, הוא קיום של סיפור משפחתי של סרטן שד ושחלות במשפחה.
כיום ברור שמוטציות בתאי האב בשני גנים – BRCA1 ו-BRCA2 הם אחראיות לחלק נכבד מהמשפחות שבהן נצפית תבנית של סרטן מורש: כ 80% מהמשפחות שבהן יש אבחנה של סרטן שד משולב עם סרטן השחלות ועד 40% בלבד מהמשפחות שבהם יש סרטן שד מורש אך ללא ביטוי קליני של סרטן השחלות ניתן לאתר בהן מוטציות באחד משני הגנים הללו.
מעצם ההגדרה של "מוטציות בתאי האב" ניתן לאתר מוטציות בגנים אלה על ידי בדיקת דם הדוגמת את הדנא המצוי בלויקוציטים וממנה ניתן לדעת האם יש או אין מוטציות בגנים אלה.
בשני הגנים BRCA1 BRCA2 תוארו למעלה מ 3000 מוטציות ושינויים גנטיים מאז 1994 ו-1995 בהתאמה (השנים בהם בודדו גנים אלה).
במרבית המשפחות בעולם בהן יש רקע מורש לסרטן שד ושחלות המוטציות הן ייחודיות לכל משפחה ופזורות בכל האיזורים המקדדים של הגנים.
דוגמא רלוונטית למציאות הישראלית-יהודית, למגוון מוטציות מוגבל בגנים BRCA1 BRCA2 הם הנשים היהודיות ובעיקר האשכנזיות. במשפחות שבהן יש רקע מורש לסרטן שד ושחלות באוכלוסייה היהודית האשכנזית ניתן לאתר אחת משלוש מוטציות בגן BRCA1 (185delAG, 5382InsC) או בגן BRCA2 (6174delT).
מוטציות אלה - המכונות מוטציות עיקריות – (predominant mutations) - הן המוטציות העיקריות הנבדקות בישראל במשפחות בסיכון גבוה לסרטן שד ושחלות. ישנן בנשים יהודיות ממשפחות בסיכון גבוה עוד כמה מוטציות שכיחות פחות אך חוזרות על עצמן באוכלוסיות אתניות ספציפיות:
|
מוצא אתני |
גן |
מוטציה |
|
עירקי אירני אפגני |
BRCA1 |
Tyr978X |
|
צפון אפריקאי |
BRCA1 |
981delAT |
|
רוסי לא יהודי |
BRCA1 |
4153delA |
|
בלקני |
BRCA2 |
A1708E |
|
תימני |
BRCA2 |
8765delAG |
|
אשכנזי |
BRCA2 |
4075delGT |
פרט למוטציות אלה קיימות עוד כ 90 מוטציות נוספות שתוארו אי פעם בנשים ממוצא יהודי בישראל ובעולם. לנשים ישראליות ממוצא ערבי מוסלמי או נוצרי ולנשים ממוצא דרוזי אין מוטציות שחוזרות על עצמן אך גם אצלן אותרו מוטציות ספציפיות בגנים BRCA1 BRCA2 בחלק קטן מהמשפחות בסיכון גבוה.
בשל הספקטרום המצומצם של מוטציות בגנים BRCA1 BRCA2 בקרב נשים יהודיות בישראל ניתן להעריך עד כמה נפוצות מוטציות אלה (= שלוש המוטציות העיקריות) בקרב נשים בישראל המבטאות מחלות שונות ורקע גנטי שונה.
|
אוכלוסייה |
שיעור נשאות |
|
סרטן שד (אשכנזים) בכל גיל |
10-12% |
|
סרטן שד >35 שנים |
25-30% |
|
סרטן שחלות בכל גיל |
29% |
|
סרטן שחלות (אשכנזי) |
35% |
|
סרטן שד ושחלות במשפחה |
60-65% |
|
אוכלוסייה כללית (אשכנזים) |
2.5% |
|
אוכלוסייה כללית (עירקים) |
0.5% |
המשמעות של נשאות המוטציה
BRCA1 - לאישה שנושאת מוטציה בגן BRCA1 הסיכון לפתח סרטן שד וסרטן השחלות לאורך החיים עולה באופן משמעותי מעבר לסיכון של האוכלוסייה הכללית, אך החדירות – penetrance- איננה מלאה כלומר לא כל אישה נשאית תפתח סרטן. מחקרים רבים נכתבו ופורסמו בניסיון להעריך מהי רמת הסיכון לאורך החיים של נשאיות מוטציות בגן BRCA1 לפתח סרטן. רמת הסיכון המצוטטת משתנה ממחקר למחקר ונעה בין 50-84% לפתח סרטן שד ו20-50% לפתח סרטן שחלות (פי 7 ופי 30 יותר מהסיכון לפתח סוגי סרטן אלה באוכלוסייה הכללית, בהתאמה).
ספציפית מחקרים שהתמקדו בנשים יהודיות בישראל ובארה"ב שהן נשאיות של מוטציות בגן זה ההערכה היא שהסיכון לסרטן שד עד גיל 75 שנים נע סביב 75-83% ולסרטן שחלות 45-55%.
רמת הסיכון האישית תלויה בגורמים נוספים כמו מספר לידות, נטילת גלולות למניעת הריון או טיפול הורמוני חליפי, גיל הופעת מחזור, עיסוק בספורט ההיסטוריה הספציפית של סרטן וסוגיו במשפחה מיקום המוטציה בגן קיומם שינויי רצף – פולימורפיזמים - בגנים אחרים ועוד גורמים רבים המכונים באופן קולקטיבי – גורמי משני סיכון – Modifier factors.
התרומה היחסית של כל אחד מגורמים אלה ושיעור השפעתם על החדירות של מוטציה בגן BRCA1 אינה ידועה עדיין.
BRCA2 - נשאות של מוטציה בגן BRCA2 גם היא מעלה את הסיכון לפתח סרטן שד וסרטן שחלות לאורך החיים באופן משמעותי מעבר לסיכון בנשים באוכלוסייה הכללית: רמת הסיכון לנשאיות לסרטן שד נעה בין 50-70% ולסרטן שחלות 11-59%.
אחד ההבדלים בין סרטן המתפתח בנשאיות של מוטציות בגן BRCA2 בהשוואה לסרטן המתפתח אצל נשים נשאיות של מוטציות בגן BRCA1 הוא שהסרטן מתפתח בגיל מאוחר יותר בגיל הקרוב יותר לגיל ההופעה באוכלוסייה הכללית.
בנוסף לסוגי סרטן אלה מוטציה בגן BRCA2 מעלה גם את הסיכון לפתח סוגי סרטן נוספים: סרטן לבלב סרטן קיבה סרטן דרכי מרה בשיעורים לא ברורים וההערכה היא שרמת הסיכון של נשאי מוטציה בגן BRCA2 היא עד 10% לאורך החיים (בהשוואה לסיכון של 1-2% לכל אחד מסוגי הסרטן הללו באוכלוסייה הכללית).
גברים נשאי המוטציות: גם גברים יכולים להיות כמובן נשאים של מוטציות בגנים BRCA1 ו-BRCA2. רמת הסיכון האישית של גבר נשא של מוטציה בגן BRCA2 עולה עד 6% לפתח סרטן שד (פי 12 מכל גבר אחד באוכלוסייה הכללית) וכן את סוגי הסרטן הנוספים: לבלב, קיבה, סרטן דרכי המרה.
הנתונים הקיימים היום אינם תומכים בכך שהמוטציות בגנים BRAC1 BRCA2 מעלים אישית את הסיכון של גברים לפתח סרטן של הערמונית או סרטן של המעי הגס.
עיקר הדחף אצל גברים לבצע את הבדיקה הגנטית הוא היכולת של גברים נשאים להעביר את המוטציה לכל אחד מצאצאיהם – בנים ובנות: הסיכון לכל אחד מהילדים של נשא הוא 50% להיות גם נשא (בהתאם למודל של הורשה אוטוזומית דומיננטית).
יצא לי לדסקס עם בנות "נשאיות" לגבי מה יותר עדיף: BRCA1 או BRCA2 ?
והמסקנה: זה נבלה וזה טרפה...
נראה שבנות עם BRCA2 יכולות (אולי) לדחות קצת את ניתוח הכריתה המניעתית, כי סרט"הש מתפתח (סטטיסטית) בגיל מאוחר יותר ובהסתברות קטנה יותר. מאידך, נפגשתי באשפוז שלי עם נשאית BRCA2, שלמדה על נשאותה בדיעבד, וחלתה בסרטן השד בגיל 38!
אבחנה
- אבחנה מעבדתית – כאמור נשאות של המוטציות ניתנת לביצוע על ידי בדיקת דם פשוטה, הפקת הדנא מתאי הדם הלבנים ובדיקה של קיום או היעדר המוטציה על ידי תבחין מעבדתי פשוט. במידת הצורך ניתן להפיק DNA מבלוק פארפין, דגימת רוק, או כל דגימה אחרת שניתן להפיק ממנה חומצות גרעין.
- עצם ביצוע התהליך במעבדה – תהליך ה PCR - יכול לגרום להחדרה של מוטציות בדגימה באופן אקראי ולכן חשוב לחזור על כל בדיקה לפחות פעמיים עדיף משתי דגימות דם בלתי תלויות כדי לשלול אפשרות שלך תוצאה כוזבת חיובית.
- את הבדיקה הגנטית עדיף להציע ולבצע קודם כל אצל מי שחלה בסרטן במשפחה על מנת לראות האם יש מתאם בין המוטציות הספציפיות שנבדקות בישראל לתחלואה מסרטן שד ושחלות. כמובן שמי שהוריו אינם נשאים – אינו יכול להיות נשא של מי מהמוטציות הנ"ל.
טיפול בנשאיות, שלא חלו (עדיין) בסרטן
סרטן שד
האופציות העומדות כיום בפני בפני נשאיות הינן:
1. להיות במעקב לשם גילוי מוקדם של סרטן שד, וזאת על ידי:
א. בדיקה ידנית של השדיים על ידי רופא אחת ל6 חודשים
ב. הדמיה של השד אחת לשנה. לנשים צעירות בדיקת ההדמיה המומלצת היא MRI של השדיים.
ג. עוד סוג של הדמיה אחרת (סונאר או ממוגרפיה) גם אחת לשנה
ד. כך שאחת ל 6 חודשים תהיה הדמיה של השד.
שמנה לב שאם בחרתן באופציה זו:
א. אתן לא מונעות את הופעת הסרטן, אלא ערניות יותר, בתקווה שלא יהיה סרטן, אבל אם יהיה- יגלו אותו בשלב מוקדם.
ב. ניתוח הכריתה והשחזור עקב מחלה (שיידרש, קרוב לוודאי), יהיה שונה מכריתה ושחזור מניעתית, כשאת לא חולה: למרבית החולות בסרטן, לא משאירים את הפטמות והשחזור לא תמיד מיידי או מצליח, עקב הקרנות, הפוגעות בעור.
 |
| אחותינו היקרה, אנג'לינה. נראית נפלא גם עם ציצים משוחזרים! |
2. ניתוחים להסרת שדיים, עם או בלי שחזור:
הדרך היחידה להקטנה אקטיבית של הסיכון לפתח סרטן שד היא על ידי הסרת שדיים דו צדדית, עם או בלי שחזור. הגישה הזו מקטינה סיכון לפתח סרטן שד עד 90% מהסיכון העודף אך אין מניעה מושלמת. לכן גם לאחר הניתוח להסרת השדיים להקטנת סיכון מומלץ להקפיד על משטר מעקב לגילוי מוקדם של סרטן שד.
כיום ניתוחים אילו מפותחים יותר והניתוח הנפוץ שמתבצע הינו "ריקון" תוכן השד ומילוי השד ברקמה עצמונית (רקמות גוף: לרוב גב או בטן) או בשתלי סיליקון . כך שכלפי חוץ יש לבחורה שדיים אך בפנים- אין רקמת שד. "ללכת בלי ולהרגיש עם".
3. טיפול תרופתי בטמוקסיפן:
התרופה אושרה בשנת 1997 בארה"ב, לנשים בסיכון גבוה בארה"ב לשם הקטנת סיכון אבל נותנים, בעיקר, לנשים שכבר חלו בסרטן השד, כדי למנוע את הישנות המחלה וקראתי שזה אפקטיבי יותר לנשים עם BRCA2. בכל אופן, כיום לא מקובל להציע לאישה ללא אבחנת סרטן טיפול מונע תרופתי זה.
4. טיפולים ניסיוניים:
השתתפות במחקר קליני למניעת סרטן אצל נשאיות. הייתרון: אולי זה עובד ובכל מקרה, הניסוי ייתרום למדע ולפיתוח תרופות עתידיות. החיסרון: אולי זה לא עובד? לא כל מה שעובד על עכברים וקופים עובד על בני אדם...
סרטן שחלות
 |
| כך נראה סרטן השחלות. קשה לגילוי מוקדם! |
אין משטר מעקב יעיל לגילוי מוקדם של סרטן השחלות. עובדה זו, יחד עם הסיכון הגבוה משמעותית לפתח סוג זה של ממאירות בנשאיות, גורמים להמלצה לבצע הסרת שחלות (וחצוצרות) מקטינת סיכון סביב גיל 35-40 שנים ו/ או לאחר תום יצירת המשפחה.
אין צורך להסיר את הרחם שכן אין עלייה בסיכון לפתח סרטן של הרחם משנית למוטציות בגנים BRCA1 BRCA2.
הסרת השחלות מקטינה סיכון לפתח סרטן שחלות אך יש סיכוי של 1-3% לפתח סרטן ראשוני של הצפק - Primary peritoneal carcinomatosis גם לאחר הסרת השחלות והחצוצרות.
לנשים צעירות יותר שעוד לא הגיעו לגיל שבו מומלצת הסרת השחלות, מומלץ לדבוק במשטר מעקב לגילוי מוקדם – תוך הדגשה שהוא אינו יעיל מספיק - עד הגיל בו הן מבצעות את הסרת השחלות המונעת. משטר זה כולל בדיקה ידנית על ידי גניקולוג, סונאר טראנס וגינלי ובדיקת סמן בדם CA 125 אחת ל-6 חודשים.
פרוגנוזה- טיפול בנשאיות BRCA שחלו בסרטן
- מהלך המחלה והתגובה לטיפול כירורגי כימי או קרינתי בקרב נשים נשאיות שחלו בסרטן השד והשחלות אינו גרוע יותר או טוב יותר מנשים שחלו בסוגי סרטן אלה שאינן נשאיות.
- לנשים שחלו בסרטן השד על רקע מוטציה בגן BRCA1 או BRCA2 יש אופציה (מחקרית בשלב הזה) לקבל טיפול על ידי תכשיר שבולם אנזים בשם PARP- PARP inhibitor שמיועד כתוספת לטיפול כמוטרפי אצל נשים עם סרטן שד גרורתי שלא מגיבות לטיפול כימי בלבד.
דגלים אדומים
נקודות הדורשות תשומת לב מיוחדת
- קיימת דעה רווחת בציבור ובקרב רופאים גם שאם אין היסטוריה של סרטן שד ושחלות מצד האם ההיסטוריה של ממאירויות אלה מצד האב אינה רלוונטית.
משפט זה וגישה זו אינם נכונים: מיקומם של הגנים BRCA1 (על הזרוע הארוכה של כרומוסום 17) ו-BRCA2 (על הזרוע הארוכה של כרומוסום 13) מעידים שמוטציות יכולות להיות מורשות הן מהאב והן מהאם. ולכן ההיסטוריה המשפחתית של סרטנים נשיים מצד האב היא מאוד משמעותית בהחלטה האם להציע את הבדיקה הגנטית לגברים. לכן מקובל לבצע בדיקה גנטית לגברים שבמשפחותיהם יש היסטוריה חשודה לרקע מורש לסרטן שד ושחלות שיכולים להיות נשאים ולכן יכלים להוריש את המוטציות בגנים אלה לבנותיהם.
- "לא צריך לבדוק נשים שחלו כי למידע אין כל ערך - הן ממילא חלו". המידע הגנטי הוא בעל ערך לחולת סרטן שד עצמה (בהחלטה למשל האם לבצע כריתת שד מלאה או חלקית עם קרינה, בהחלטה האם ומתי לבצע כריתת שחלות מונעת) וכמובן מאפשרת מתן תשובה ואינטרפרטציה הגיונית ורציונלית לגבי תשובה שלילית אצל קרובות משפחתה: אישה שהיא לא נשאית במשפחה שבה אותרה מוטציה – אינה בסיכון גבוה לפתח סרטן שד ושחלות. אישה שאינה נשאית אבל לא נבדקה מי שחלתה בסרטן היא עדיין בסיכון גבוה לפתח סרטן במבוסס על הסיפור המשפחתי.
Tags: סקסיות, Ovarian Cancer, סרטן שחלות, סרטן שד, רפואה ציבורית, שחזור שד, ניתוח פלסטי, נשיות, אנג'לינה ג'ולי, מוטציה גנטית, כריתת שדיים מניעתית, genemutation, Angelina Jolie, Prophylactic Mastectomy, mastectomy, Breast Cancer, BRCA2, BRCA1, BRCA


